- Autor Jason Gerald gerald@how-what-advice.com.
- Public 2023-12-16 11:37.
- Naposledy zmenené 2025-01-23 12:44.
Ak vám príde periodická tabuľka mätúca a ťažko zrozumiteľná, nebojte sa, nie ste sami! Pochopenie fungovania periodickej tabuľky môže byť náročné, ale keď sa ju naučíte čítať, budete vo vede úspešní. Začnite tým, že porozumiete štruktúre periodickej tabuľky a informáciám, ktoré zobrazuje o prvkoch. Ďalej môžete študovať každý z prvkov. Nakoniec pomocou informácií uvedených v periodickej tabuľke zistite počet neutrónov v atóme.
Krok
Časť 1 z 3: Pochopenie štruktúry periodickej tabuľky
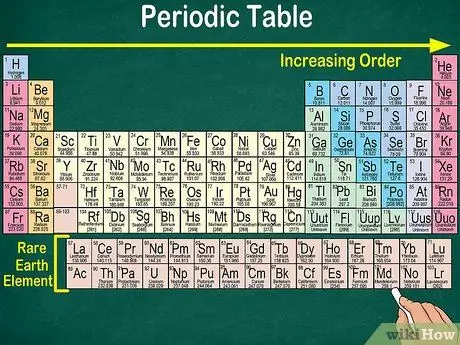
Krok 1. Prečítajte si periodickú tabuľku zhora zľava doprava
Prvky sú usporiadané podľa ich atómového čísla. Čím viac vpravo a dole, tým vyššie je atómové číslo. Atómové číslo je počet protónov, ktoré má atóm prvku. Keď pôjdete ďalej doprava, všimnete si tiež, že sa zvyšuje hmotnostný počet každého atómu. To znamená, že môžete pochopiť váhu prvku dokonca aj pri pohľade na jeho umiestnenie na stole.
- Čím viac doprava alebo nadol, atómová hmotnosť prvku sa zvýši, pretože atómová hmotnosť sa vypočíta súčtom protónov a neutrónov v každom atóme prvku. Počet protónov sa zvyšuje s prvkom, čo znamená, že sa zvyšuje aj jeho hmotnosť.
- Elektróny nie sú zahrnuté v atómovej hmotnosti, pretože v porovnaní s protónmi a neutrónmi nemajú elektróny veľký vplyv na atómovú hmotnosť.

Krok 2. Pochopte, že každý prvok vľavo obsahuje o 1 protón viac ako atóm
Môžete to zistiť pohľadom na atómové číslo. Atómové čísla sú usporiadané zľava doprava. Prvky sú tiež rozdelené do 3 skupín, zoskupenie vidíte v tabuľke.
V prvom riadku je napríklad uvedený vodík, ktorý má atómové číslo 1, a hélium, ktoré má atómové číslo 2. Tieto dva prvky sa však nachádzajú úplne vľavo a vpravo od tabuľky, pretože sú v rôznych skupinách
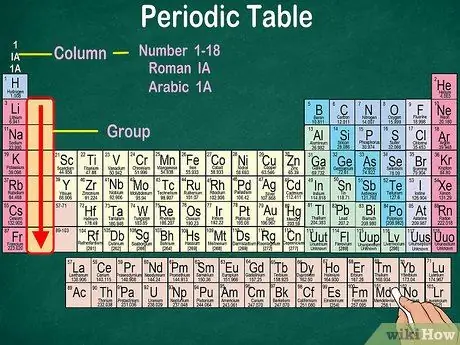
Krok 3. Identifikujte skupiny atómov, ktoré majú rovnaké fyzikálne a chemické vlastnosti
Skupiny sú označené zvislými stĺpcami. Skupiny sa vo väčšine prípadov vyznačujú rovnakou farbou. To vám pomôže identifikovať, ktoré prvky majú podobné fyzikálne a chemické vlastnosti. Vďaka tomu budete môcť jednoduchšie predpovedať reakcie týchto prvkov. Každý prvok v danej skupine má vo svojom najvzdialenejšom orbitáli rovnaký počet elektrónov.
- Väčšina prvkov patrí iba do jednej skupiny. Vodík však môže byť klasifikovaný buď ako halogén, alebo ako alkalický kov. V niektorých tabuľkách sa vodík vyskytuje v oboch skupinách.
- Vo väčšine prípadov budú stĺpce očíslované od 1 do 18, a to buď v hornej alebo dolnej časti tabuľky. Čísla môžu byť zobrazené rímskymi číslicami (IA), arabskými číslicami (1A) alebo číslami (1).
- Prečítajte si atómové skupiny zhora nadol.
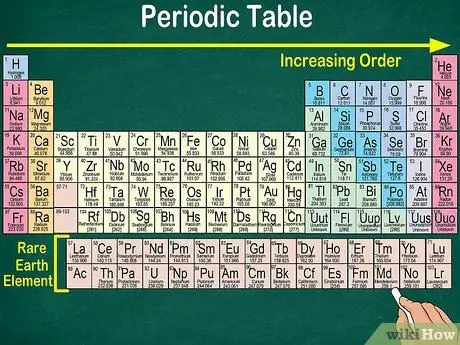
Krok 4. Všimnite si prázdneho miesta v tabuľke
Usporiadanie prvkov do skupín a skupín zohľadňuje okrem atómového čísla aj rovnaké fyzikálne a chemické vlastnosti. Tak lepšie porozumiete tomu, ako jednotlivé prvky reagujú. Pridanie chemických prvkov sťažuje ich klasifikáciu, a preto nie je prekvapujúce, že periodická tabuľka obsahuje prázdne miesto.
- Napríklad prvé 3 riadky majú prázdne medzery, pretože prechodné kovy, ktoré sú uvedené v tabuľke, sú prvky s atómovým číslom 21.
- Podobne sú prvky 57 až 71, ktoré sú prvkami vzácnych zemín alebo prvkami vzácnych zemín, znázornené oddelene v pravom dolnom rohu tabuľky.
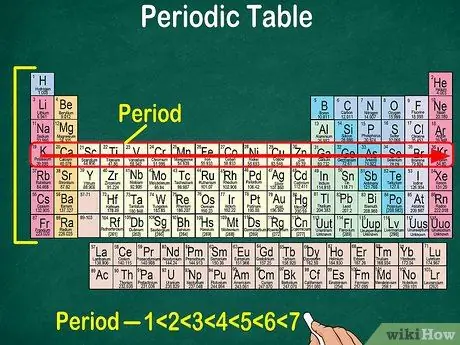
Krok 5. Všimnite si, že každý riadok sa nazýva bodka
Všetky prvky v období majú rovnaký počet atómových orbitálov, ktorými prechádzajú elektróny. Počet orbitálov bude zodpovedať počtu periód. Periodická tabuľka zobrazuje 7 riadkov, čo znamená, že existuje 7 bodiek.
- Napríklad prvok v období 1 má 1 orbitál, zatiaľ čo prvok v období 7 má 7 orbitálov.
- Vo väčšine prípadov sú bodky očíslované od 1 do 7 zhora nadol na ľavej strane tabuľky.
- Prečítajte si periódu prvkov sledujúcich riadok zľava doprava.
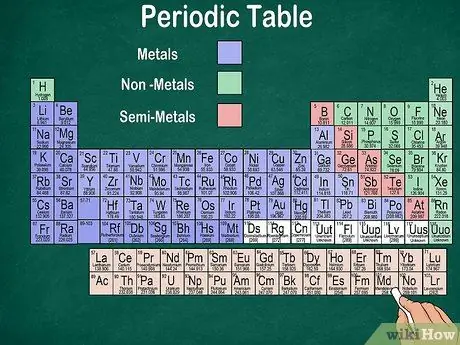
Krok 6. Rozlišujte kovy, polokovy a nekovy
Vlastnosti prvkov môžete lepšie porozumieť rozpoznaním typu prvku. Našťastie väčšina periodickej tabuľky používa farbu na označenie, či je prvok kovový, polokovový alebo nekovový. Na pravej strane stola nájdete kovové prvky, na ľavej strane nekovy. Skupina polokovov sa nachádza medzi kovmi a nekovmi.
- Vďaka svojim vlastnostiam je možné vodík zoskupiť s halogénmi alebo alkalickými kovmi. Preto je prirodzené, že sa vodík objaví na oboch stranách stola alebo má inú farbu.
- Prvok sa nazýva kov, ak je lesklý, pevný pri izbovej teplote, vedie teplo a elektrinu a je mäkký a elastický.
- Prvok sa považuje za nekovový, ak nie je lesklý, nevedie teplo ani elektrinu a je tvrdý. Tieto prvky sú pri izbovej teplote obvykle plynné, ale pri určitých teplotách môžu byť aj pevné alebo kvapalné.
- Prvok sa nazýva semimetalový, ak má kombinované vlastnosti kovu a nekovu.
Časť 2 z 3: Štúdium prvkov
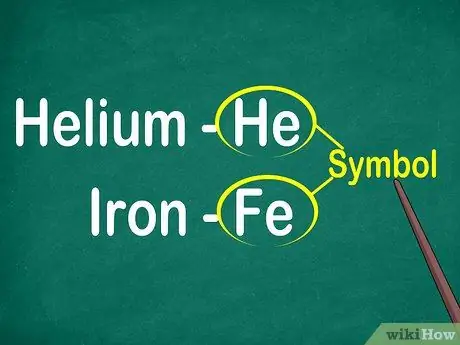
Krok 1. Identifikujte symboly prvkov od 1 do 2 písmen
Symbol sa zvyčajne nachádza v strede štvorca s veľkým písmom. Symboly sú skratky pre názvy prvkov, ktoré boli štandardizované v rôznych jazykoch. Pri experimentoch alebo práci na elementárnych rovniciach pravdepodobne použijete symboly prvkov. Preto sa vám to páči alebo nie, musíte sa zoznámiť s elementálnymi symbolmi.
Symboly sú zvyčajne odvodené z latinského názvu prvku, ale niekedy sú odvodené od názvov, ktoré sú široko používané, najmä od nových prvkov. Symbolom pre hélium je napríklad On, čo znamená toto známe meno. Symbolom železa je však Fe, ktorý je na prvý pohľad pomerne ťažko rozpoznateľný

Krok 2. Nájdite úplný názov prvku, ak existuje
Toto je názov prvku, ktorý použijete, ak si ho musíte zapísať celý. Napríklad „hélium“a „uhlík“sú názvy prvkov. Vo väčšine prípadov je názov prvku pod symbolom, ale umiestnenie sa môže líšiť.
Niektoré periodické tabuľky nemusia obsahovať úplný názov a používať iba symboly
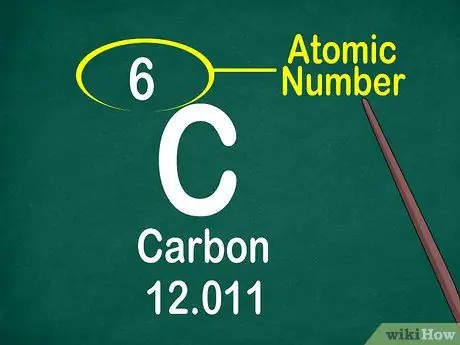
Krok 3. Všimnite si atómové číslo
Atómové číslo sa zvyčajne nachádza v hornej časti škatule, buď v strede, alebo v rohu škatule. Atómové číslo sa však môže nachádzať aj pod symbolom prvku alebo názvom prvku. Atómové čísla sú usporiadané od 1 do 118.
Atómové číslo je celé číslo, nie desatinné
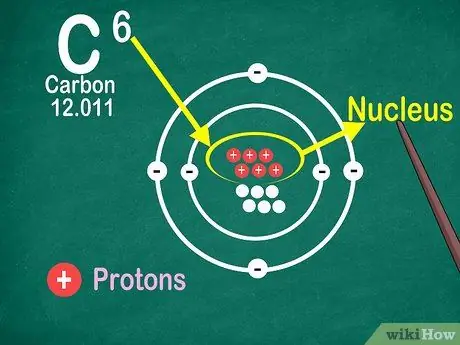
Krok 4. Vedzte, že atómové číslo je počet protónov v atóme
Všetky atómy v prvku majú rovnaký počet protónov. Na rozdiel od elektrónov protóny nemôžu byť zachytené alebo uvoľnené atómami. Prvky sa zmenia, ak atómy môžu atómy zachytávať alebo strácať.
Atómové číslo potrebujete aj na zistenie počtu elektrónov a neutrónov
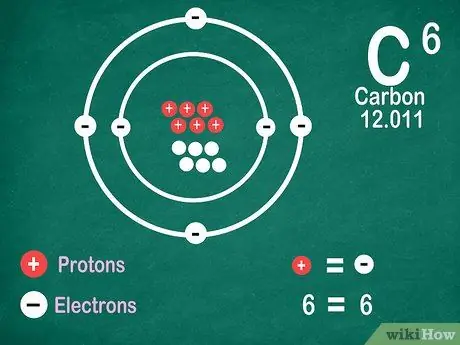
Krok 5. Vedzte, že prvky obsahujú rovnaký počet elektrónov ako protóny, pokiaľ prvok neprechádza ionizáciou
Protóny majú kladný náboj, zatiaľ čo elektróny majú záporný náboj. Pretože neutrálny atóm nemá elektrický náboj, znamená to, že má rovnaký počet elektrónov a protónov. Atómy však môžu strácať a získavať elektróny, čo ich robí ionizovanými.
- Ióny sú elektrické náboje. Ak je v ióne viac protónov, náboj je kladný, čo je znamienko plus (+) vedľa symbolu iónu. Ak je počet elektrónov v ióne vyšší, náboj je záporný, čo je záporný (-).
- Ak atóm nie je ión, neuvidíte pozitívne ani negatívne znamienko.
Časť 3 z 3: Použitie atómovej hmotnosti na počítanie neutrónov

Krok 1. Poznáte atómovú hmotnosť
Atómová hmotnosť sa zvyčajne nachádza v spodnej časti škatule pod symbolom prvku. Atómová hmotnosť je kombinovaná hmotnosť častíc v atómovom jadre vrátane protónov a neutrónov. Ióny však môžu proces počítania skomplikovať. Atómová hmotnosť teda označuje priemernú atómovú hmotnosť prvku a atómovú hmotnosť jeho iónov.
- Väčšina atómov má kvôli svojej priemernej hmotnosti atómovú hmotnosť v desatinnej forme.
- Napriek tomu, že hmotnosť prvku vyzerá, akoby sa zvyšoval zľava doprava, nie vždy to tak je.
Krok 2. Určte hmotnostné číslo prvku, ktorý študujete
Hmotnostné číslo môžete nájsť zaokrúhlením atómovej hmotnosti. Táto skutočnosť dokazuje, že atómová hmotnosť je priemerom všetkých atómových hmotností vrátane iónov.
Atómová hmotnosť uhlíka je napríklad 12 011, takže je zaokrúhlená na 12. Podobne je atómová hmotnosť železa 55,847, takže je zaokrúhlená na 56
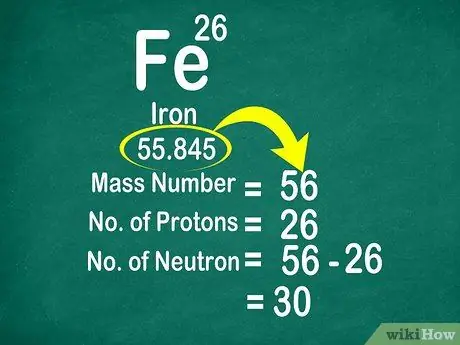
Krok 3. Na spočítanie neutrónov odpočítajte hmotnostné číslo od atómového čísla
Hmotnostné číslo sa dá vypočítať pripočítaním počtu protónov k počtu neutrónov. To vám uľahčí výpočet počtu neutrónov v atóme odčítaním hmotnostného čísla od počtu protónov.
- Použite tento vzorec: Neutrón = hmotnostné číslo - protón
- Hmotnostný počet uhlíkov je napríklad 12 a má 6 protónov. Môžeme teda vedieť, že uhlík má 6 neutrónov, pretože 12 - 6 = 6.
- Ďalší príklad, hmotnostný počet železa je 56 a má 26 protónov. Vieme teda, že železo má 30 neutrónov, pretože 56 - 26 = 30.
- Izotopy atómov obsahujú rôzny počet neutrónov, takže sa mení ich atómová hmotnosť.
Tipy
- Čítanie periodickej tabuľky je pre niektorých ľudí náročné. Nenechajte sa odradiť, ak je pre vás ťažké študovať periodickú tabuľku!
- Farby v tabuľke sa môžu líšiť, ale obsah zostáva rovnaký.
- Niektoré periodické tabuľky môžu poskytovať neúplné informácie. Niektoré tabuľky napríklad uvádzajú iba symbol a atómové číslo. Za týmto účelom vyhľadajte stôl, ktorý vyhovuje vašim potrebám!






